Слабые электролиты список, 2. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ

Емкость двойного слоя в отсутствие специфической адсорбции ГЛАВА 5. Квадратными скобками обозначены равновесные концентрации. Пример задания из КИМ ЕГЭ: Установите соответствие между формулой вещества и его способностью проводить электрический ток: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Стандартные скорости
Разработка сайта: Селивёрстов Вячеслав Васильевич. Электролиты и неэлектролиты. Сильные и слабые электролиты.
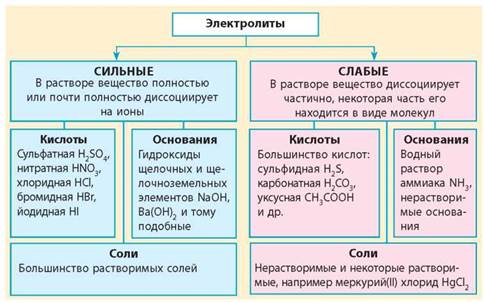
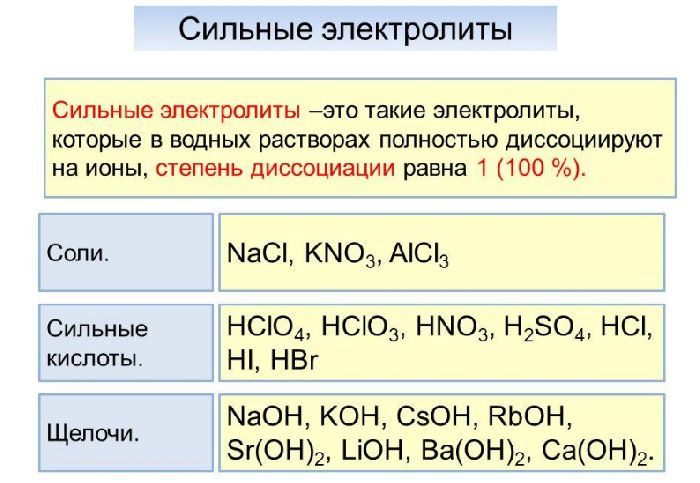
Электролиты и неэлектролиты Сильные и слабые электролиты Электролиты и неэлектролиты Вещества можно классифицировать не только на привычные для всех кислоты, соли, основания и оксиды, но и по другим особенностям, например, по физическим свойствам. Электролиты — вещества, растворы или расплавы которых проводят электрический ток. Неэлектролиты — вещества, растворы или расплавы которых не проводят электрический ток. Сильные и слабые электролиты Даже электролиты проводят ток неодинаково.
Установите соответствие между формулой вещества и его способностью проводить электрический ток: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Автор Селивёрстова Алиса Андреевна. Эти уравнения лишь упрощенно отражают процесс в растворе. Он осложняется образованием ионных пар и ассоциаций. Для соединений ионного характера щелочей, солей. Способность кислоты отдавать протон, а основания принимать его то есть силу кислот и оснований можно охарактеризовать константами равновесия, которые называют соответственно константой кислотности K a и константой основности. Расчет рН проводится с учетом того, что сильные кислоты и основания в водных растворах полностью диссоциируют на ионы.
Пример 3. Рассчитать рН 0,01 М раствора соляной кислоты. Пример 4. Рассчитать рН 0, М раствора гидроксида натрия. Записываем уравнение, соответствующее процессу диссоциации серной кислоты:.
В данном случае, так же как в примерах 3 и 4, рН раствора будет определяться концентрацией ионов водорода, образующихся в результате диссоциации кислоты:. Расчет рН растворов слабых кислот и оснований проводится, если известна степень или константа диссоциации кислоты или основания. Пример 6. Рассчитать рН 0,04 М раствора гидроксида аммония, если степень его диссоциации равна 0, Пример 7. Суммарная концентрация ионов водорода равна:. Пример 8. Рассчитать рН 0, М раствора угольной кислоты, учитывая диссоциацию по двум ступеням, если.
Записываем уравнение диссоциации H 2 СО 3 по. Находим концентрацию ионов водорода, образовавшихся в результате диссоциации кислоты по 1-ой ступени:.
Записываем уравнение диссоциации H 2 СО 3 по второй ступени:. Находим концентрацию ионов водорода, образовавшихся в результате диссоциации кислоты по 2-ой ступени:. Рассчитать рН 0, М раствора сероводородной кислоты, учитывая диссоциацию по двум ступеням. Рассчитать рН 0, М раствора кремниевой кислоты, учитывая диссоциацию по двум ступеням. Рассчитать рН 0, М раствора сернистой кислоты, учитывая диссоциацию по двум ступеням. Файловый архив студентов.
Логин: Пароль: Забыли пароль? Email: Email повторно: Логин: Пароль: Принимаю пользовательское соглашение. FAQ Обратная связь Вопросы и предложения. Добавил: Upload Опубликованный материал нарушает ваши авторские права? Сообщите нам. Санкт-Петербургский государственный технологический институт технический университет. Скачиваний: Теория электролитической диссоциации Аррениус Теория относится к растворам слабых электролитов и основана на трех постулатах: 1.
Закон разбавления Оствальда Закон определяет взаимосвязь между константой и степенью диссоциации в растворах слабых электролитов. Задачи-тренажеры Рассчитать степень диссоциации: 1. Задачи-тренажеры 1.

Водородный показатель Существует несколько теоретических концепций ки- слотно-основных превращений. С точки зрения кислотно-основных свойств растворители можно разделить на три группы: 1 апротонные растворители, не обладающие ни кислотными, ни основными свойствами — например, углеводороды и их галогенпроизводные: бензол, гексан, хлороформ; 2 протофильные растворители, обладающие только основными свойствами: кетоны ацетон , простые эфиры диоксан, диэтиловый эфир , третичные амины пиридин ;.
Вещества HA и B могут быть заряженными и незаря- женными. Способность кислоты отдавать протон, а основания принимать его то есть силу кислот и оснований можно охарактеризовать константами равновесия, которые называют соответственно константой кислотности K a и константой основности K b. Расчет рН водных растворов сильных и слабых кислот и оснований 1 Расчет рН растворов сильных кислот и оснований без учета коэффициентов активности ионов Расчет рН проводится с учетом того, что сильные кислоты и основания в водных растворах полностью диссоциируют на ионы.
Для того, чтобы мы могли качественно предоставить Вам информацию, мы используем cookies, которые сохраняются на Вашем компьютере сведения о местоположении; ip-адрес; тип, язык, версия ОС и браузера; тип устройства и разрешение его экрана; источник, откуда пришел на сайт пользователь; какие страницы открывает и на какие кнопки нажимает пользователь; эта же информация используется для обработки статистических данных использования сайта посредством интернет-сервисов Google Analytics и Яндекс.
Отключить cookies Вы можете в настройках своего браузера. Поиск по серверу. Стокс Растворы электролитов В книге отражены итоги многолетней работы известных английских исследователей в области физической химии растворов электролитов. Издательство иностранной литературы Москва Диэлектрическая постоянная и дипольный момент полярных жидкостей. Глава 2. Основные понятия и определения. Коэффициенты активности, стандартные состояния и шкалы концентраций для растворов электролитов.
Связь между коэффициентом активности и парциальными моляльными величинами: теплосодержанием, теплоемкостью и объемом. Связь между изменением свободной энергии и потенциалом гальванического элемента.

Связь между эквивалентной электропроводностью и абсолют ной подвижностью иона. Глава 3. Состояние растворенного вещества в растворах электролитов. Глава 4. Функция распределения и потенциал ионов.
Глава 5. Глава 6. Предельная подвижность ионов.
Глава 7. Зависимость электропроводности и чисел переноса от концентрации. Приложение к теории электрофоретического эффекта. Вычисление коэффициентов активности из данных по точкам замерзания. Вычисление коэффициентов активности при температурах, от личных от точки замерзания.